Какие структурные составляющие имеет сталь 40 при комнатной температуре
Сталь 40 – Диаграмма состояния Fe – Fe3C и кривые охлаждения Указанный сплав (Сталь 40) содержит 0,4 % углерода и отмечен вертикальной линией, которая имеет следующие характерные точки: 1 – расплав (область жидкого металла); 2 – линия ликвидус; 3 – линия перитектической реакции (Жв + ФH →АJ); 4 – линия солидус; 5 – критическая точка А3; 6 – критическая точка А1; 7 – комнатная температура. Кривая охлаждения Стали 40 От температуры 1 до температуры 2 происходит охлаждение расплава. При температуре 2 из расплава начинает выделяться Феррит (Ф). В точке 3 происходит перитектическая реакция Жв + ФH →АJ, и до точки 4 сплав находится в состоянии двух фаз – А+Ж. В точказ от 4 до 5 сплав имеет однофазную Аустенитную (А) структуру. В точке 5 из Аустенита (А) начинает выделяться вторичный Феррит (Ф) и этот процесс продолжается до точки 6. В точке 6 происходит эвтектоидное превращение, при котором Аустенит распадается на Перлит (П) – механическую смесь Феррита и Цементита (А0,8% → П (Ф + ЦII), в результате при комнатной температуре сплав имеет структуру Перлита и избыточного Феррита. Согласно правилу фаз (C = K – Ф + 1, К – количество компонентов, Ф – количество фаз): Для точки 2: C2 = 2 – 2 + 1 = 1, т.е. температура может снижаться, но при появлении второй фазы будет выделяться скрытая теплота и скорость охлаждения будет снижаться. Для точки 3: C3 = 2 – 3 + 1 = 0. В точке перитектического превращения одновременно существует три фазы – расплав (Ж), Феррит (Ф) и Аустенит (А). Это означает, что до завершения превращения процесс будет протекать без изменения температуры. В зоне от 3 до 4 сплав состоит из двух фаз (С = 1), от 4 до 5 имеем однофазную зону (А), где правило фаз обычно не используется (C = 2 – 1 +1 = 2). Начиная с точки 5 из А-та выделяется Феррит (Ф) и согласно правилу фаз: C = 2 – 2 + 1 = 1. Процесс выделения Ф-та продолжается до точки 6, в связи с выделением скрытой теплоты кристаллизации второй фазы скорость охлаждения замедлится. В точке 6 Аустенит обогатится углеродом до эвтектоидного состояния и произойдет превращение А0,8% → П (Ф + ЦII). Т.к. в равновесии будут находиться три фазы (C=0) и превращение протекает без изменения температуры. Ниже точки 6 сплав имеет двухфазную структуру, которая охлаждается без каких-либо изменений и без выделения скрытой теплоты. Выберем температуру (а) в двухфазной зоне (Ж + А) и посредством правила отрезков определим количество данных фаз и содержание в них углерода. Через точку (а) проведем горизонтальную линию до встречи с основными линиями диаграммы – точка (b)-линия солидуса и точка (c) – линия ликвидуса. Количество Аустенита (QA) определяется как отношение ac/bc*100: Количество расплава (Qж) определяется как отношение ba/bc*100: Сталь 40 имеет следующие структурные составляющие: – Аустенит (А) – это твердый раствор углерода в γ- железе. Максимальное содержание углерода в аустените составляет 2,14% (при температуре 1147°С) и 0,8 % при 727 0С. – Феррит (Ф) – твердый раствор углерода в α- железе. Максимальное содержание углерода в феррите составляет 0,02% при температуре 727°С. Твердый раствор углерода в высокотемпературной модификации (Feδ) называют δ- ферритом или ысокотемпературным ферритом. – Перлит (П) – это механическая смесь феррита с цементитом. Содержит 0,8% углерода, образуется из аустенита при температуре 727°С. Имеет пластинчатое строение, т.е. его зерна состоят из чередующихся пластинок феррита и цементита. |
| |||||||||||||||||||||||||||||||||||||||||||||||
Источник
Строение стали
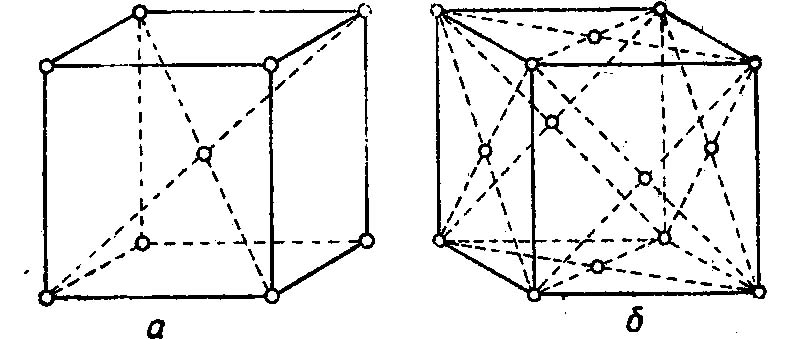
Внимательно всмотревшись в излом металла, ясно можно увидеть, что он представляет собой нагромождение (совокупность) отдельных кристаллов (зерен), крепко сцепленных между собой. Мельчайшей частицей металла, как и всякого другого вещества, является атом. В элементарных ячейках, из которых состоят кристаллы железа, атомы расположены в определенном порядке. Это расположение изменяется в зависимости от температуры нагрева. При любой температуре ниже 910° атомы в ячейках кристаллов располагаются в виде куба, образуя так называемую кристаллическую решетку альфа-железа. В этом кубе восемь атомов расположены в углах решетки и один в центре.
При нагреве свыше 910° происходит перегруппировка атомов и кристаллическая решетка представляет собою форму куба с четырнадцатью атомами; условно ее называют решеткой гамма-железа. При температуре 1390° решетка гамма-железа перестраивается в решетку с девятью атомами, носящую название дельта-железо. Эта решетка отличается от решетки альфа-железа несколько большим расстоянием между центрами атомов и сохраняется до момента расплавления железа, т. е. до 1535° (Рис. 1).
Перестройка кристаллической решетки при медленном охлаждении происходит в обратном порядке: дельта-железо при 1390° превращается в гамма-железо, а гамма-железо при 898° превращается в альфа-железо.

Рис. 1. Строение кристаллической решетки: а – альфа и дельта железа; б – гамма железа.
Критические точки превращения
На рис.2 показаны кривые охлаждения и нагревания чистого железа. Как видно из этих кривых, в процессе перестройки одной решетки в другую, а также при расплавлении и затвердевании железа происходят температурные остановки, являющиеся результатом выделения дополнительного количества тепла при охлаждении и поглощении дополнительного количества тепла при нагревании.
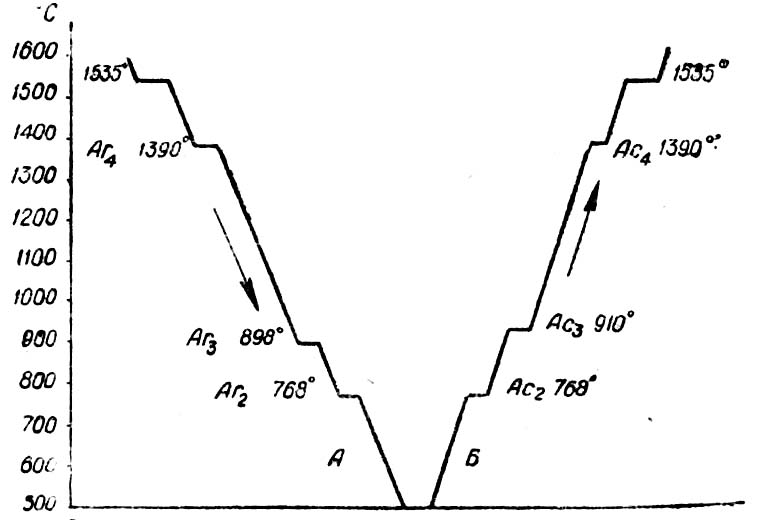
Рис. 2. Кривые охлаждения и нагрева чистого железа.
Температурные остановки, при которых происходят перестройки решеток, называются критическими температурами или критическими точками и обозначаются Аrпри охлаждении и Ас при нагревании. В точках Аr2и Ас2,не происходит перестройка атомной решетки, а изменяются магнитные свойства железа. При температуре выше 768° железо теряет способность притягиваться магнитом. При очень малой скорости нагревания и охлаждения критические точки А с3и Аr3не совпадают друг с другом на 12°. При увеличении скорости охлаждения несовпадение критических точек увеличивается, так как температура значительно снижается и железо переохлаждается. Это явление, носит название гистерезис.
При нагревании и охлаждении стали происходит также перестройка атомной решетки, но температуры критических точек не постоянны. Они зависят от содержания углерода и легирующих примесей в стали, а также от скорости нагревания и охлаждения.
На рис. 3 представлена диаграмма состояния углеродистой стали при медленном охлаждении и нагревании.
.jpg)
Рис.3. Диаграмма состояния углеродистых сталей.
Структура стали
Структурой стали называется внутреннее ее строение. Углерод в стали находится в виде химического соединения с железом, и это соединение называется – цементит. Кроме цементита, в стали имеется феррит, представляющий собой почти чистое железо. В зависимости от содержания углерода большая или меньшая часть феррита находится в механической смеси с цементитом, образуя новую структуру – перлит. Если небольшой кусок металла прошлифовать, отполировать и протравить в специальном реактиве, то под микроскопом можно различить структуры. Ниже приводится описание структур железоуглеродистых сплавов.
Аустенит представляет собою твердый раствор углерода и других элементов в гамма-железе. Наибольшее содержание углерода, которое может раствориться в ау-стените – это 2%. Аустенит образуется при затвердевании жидкой стали и при нагреве твердой стали выше критических температур.
В обычных сталях аустенит устойчив только лишь при температуре выше критических точек. При охлаждении, даже самом быстром, с этих температур аустенит превращается в другие структуры. При комнатной температуре аустенит полностью сохраняется в ряде марок нержавеющих сталей, в высокомарганцовистой стали и в незначительном количестве остается при закалке некоторых марок инструментальной и конструкционной сталей.
Аустенит мягок, пластичен, тягуч, мало упруг. Твердость его по Бринелю находится в пределах 170-220.
Аустенит немагнитен, обладает невысокой электропроводностью.
Феррит представляет собой твердый раствор углерода и других элементов в альфа-железе. Наибольшее содержание углерода, которое может раствориться в феррите, это 0,04%. Феррит устойчив при температурах ниже критической точки AC1. Он выделяется из аустенита при медленном охлаждении последнего ниже A6i. Феррит мягок, сильно тягуч. Твердость HB= 60-100. Феррит магнитен до 768°. Свыше этой температуры он теряет магнитные свойства.
Цементит представляет собой химическое соединение железа с углеродом Fe3C-карбид железа. Цементит содержит углерода 6,67%. Выделяется из жидкого и твердого раствора при медленном охлаждении. Цементит весьма тверд и хрупок. Твердость его НB= 800-820. Он магнитен до 210°. Выше этой температуры цементит теряет магнитные свойства.
Перлит представляет собой механическую смесь феррита и цементита. Он образуется из аустенита при медленном его охлаждении. Температура превращения аустенита в перлит 723°С. При весьма медленном переходе через эту температуру цементит образуется в виде зерен (глобулей), и тогда перлит называется зернистым. При более быстром охлаждении цементит приобретает форму пластинок, и такой перлит называется пластинчатым. При весьма быстром охлаждении в результате значительного переохлаждения аустенита вместо перлита получаются другие структуры, о которых речь будет ниже.
Перлит магнитен, прочен и пластичен. Твердость его находится в пределах от 160 до 230 кг/мм2 по Бринелю. При обработке резанием наиболее чистую поверхность дает структура зернистого перлита.
Мартенсит образуется в результате весьма быстрого охлаждения (закалки) аустенита. При быстром охлаждении успевает произойти перестройка кристаллической решетки гамма-железа в решетку альфа-железа, выделение же углерода в карбид железа не успевает произойти, и он весь остается растворенным в решетке альфа-железа. Так как нормально альфа-железо может растворить в себе не более 0,04% углерода, то такой раствор называют пересыщенным. Он отличается весьма большой твердостью (свыше Rc= 60) и хрупкостью. Следует указать, что решетка альфа-железа, получающаяся в результате закалки, имеет искаженную форму. Так, размеры ее граней не одинаковы – в одном направлении они удлинены за счет других (см. рис. 4). Такая решетка называется тетрагональной. Чем больше в стали углерода, тем больше тетрагональность решетки и тем более велики внутренние напряжения. При нагревании до температур 100-200° тетрагональность мартенсита уменьшается, форма кристаллической его решетки приближается к форме правильного куба, и вместе с этим уменьшаются внутренние напряжения. Мартенсит магнитен.
.jpg)
Рис. 4. Строение кристаллической решетки стали, закаленной на мартенсит.
Троостит представляет собой высокодисперсную (мелкораздробленную) смесь феррита и карбидов. Он образуется при охлаждении аустенита с замедленной против закалки скоростью или в результате нагрева (отпуска) мартенсита в пределах 250-400°.
При нагреве закаленной стали происходит постепенное выделение углерода из кристаллической решетки с образованием карбидов. Троостит менее прочен, более пластичен, чем мартенсит. Твердость его НB330-400. При охлаждении аустенита в горячих средах в интервале 250-400° (изотермическое превращение аустенита) происходит образование игольчатого троостита, несколько более прочного, чем обычный троостит.
Сорбит представляет собой дисперсную смесь феррита и карбидов. Он образуется при охлаждении аустенита с небольшой скоростью или при нагреве (отпуске) мартенсита до 400-650°. Карбиды сорбита более крупные, чем троостита. Сорбит пластичен, вязок и магнитен. Твердость НВ 270-320.
Ледебурит представляет собой эвтектическую смесь аустенита и цементита. Он содержит углерода 4 3% Образуется ледебурит при затвердевании жидкого сплава с содержанием углерода свыше 2%. Ледебурит хрупок.
На рис. 5. представлены фотоснимки структур стали с различным содержанием углерода.
Структура стали с содержанием углерода 0,83% состоит из сплошного перлита и называется эвтектоидной; при меньшем содержании углерода структура стали состоит из перлита и феррита и носит название доэвтектоидной, а при большем содержании углерода – из перлита и цементита и называется заэвтектоидной. Температура 723°, при которой перлит переходит в аустенит, также называется критической и обозначается Ас.
Для того чтобы доэвтектоидную и эвтектоидную сталь полностью отжечь, нормализовать или закалить, их нужно нагреть до такой температуры, при которой они перешли бы в аустенитное состояние.
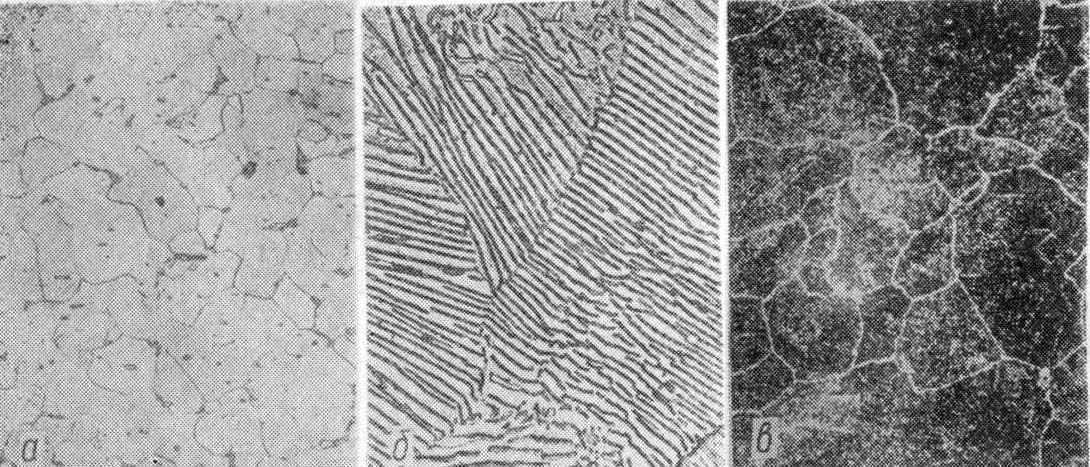
Рис. 5. Микроструктура отожженной углеродистой стали:
а – с содержанием углерода -0,1%
б – с содержанием углерода -0,85%
в – с содержанием углерода -1,1%
Превращения, происходящие в стали при нагревании
По диаграмме на рис. 3 можно проследить за изменениями структуры трех разных марок стали при нагревании:
- Сталь с содержанием углерода 0,83%. Структура стали представляет собой перлит. При температуре 723° в точке Aс1 перлит переходит в аустенит.
- Сталь с содержанием углерода 0,4%. Структура стали представляет собой перлит и феррит. При температуре 723° в точке К1 перлит переходит в аустенит, и по мере повышения температуры происходит растворение свободного феррита в аустените. При пересечении линии GS в точке К2 закончится растворение феррита и структура будет полностью состоять из аустенита. Для этой стали точка К1на диаграмме будет нижней критической точкой Ас1,а К2- верхней критической точкой Ас1,.
- Сталь с содержанием углерода 1,2%. Структура стали представляет собой перлит и цементит. При температуре 723° в точке Pi перлит переходит в аустенит, и при дальнейшем повышении температуры происходит постепенное растворение цементита в аустените. При пересечении линии SEв точке Р2 это растворение закончится. Для этой стали точка Р1 явится нижней критической точкой Ас1, а точка Ρ2 – верхней критической точкой, которая для заэвтектоидных сталей обозначается Асm.
Линия на диаграмме, обозначенная буквами GS, соответствует окончанию растворения феррита в аустените в доэвтектоидных сталях, а линия SE соответствует окончанию растворения цементита в аустените в заэвтектоидных сталях.
Следует указать, что заэвтектоидные стали при операциях термической обработки не нагревают выше линии Аcт(такая высокая температура нагрева приведет к перегреву и ухудшению свойств стали), а ограничиваются нагревом выше первой критической точки ACl, что полностью обеспечивает получение необходимых свойств.
Превращения, происходящие в стали при медленном охлаждении
В сталях, нагретых до аустенитного состояния, при весьма медленном охлаждении произойдут обратные превращения, а именно:
а) в стали с содержанием углерода 0,83% аустенит превратится в перлит;
б) в стали с содержанием углерода 0,4% сначала из аустенита начнет выделяться феррит, а затем в районе температуры 700° оставшийся аустенит превратится в перлит и
в) в стали с содержанием углерода 1,2% сначала из аустенита выделится цементит, а затем в районе температуры 700° оставшийся аустенит превратится в перлит.
Даже при весьма медленном охлаждении температура распада аустенита не совпадает с теми температурами, при которых аустенит образовался при нагревании. Чем скорость охлаждения больше, тем больше становится гистерезис, т. е. разница между критическими температурами (точками) при нагревании и охлаждении.
Превращения, происходящие в стали при быстром охлаждении
Как указывалось выше, при быстром охлаждении не успевает произойти превращение аустенита в перлит с выделением избыточного феррита или цементита, а в зависимости от скорости охлаждения аустенит превращается в новые структуры – мартенсит, троостит или сорбит. Сталь с этими структурами отличается от сталей со структурами перлита и феррита повышенной твердостью, прочностью и уменьшенной пластичностью. Если углеродистую сталь, нагретую выше критических температур, охладить очень быстро, то аустенит превратится в мартенсит и это превращение начнется лишь при температуре около 200°. При несколько меньшей скорости охлаждения образуется структура троостит, а при еще меньшей – сорбит.
В производственных условиях при охлаждении углеродистой инструментальной стали в воде образуется мартенсит, при охлаждении в масле – троостит и при охлаждении в струе воздуха -сорбит. На рис. 6 показаны микроструктуры закаленной стали.

Рис. 6. Микроструктура закаленной стали:
а – игольчатый мартенсит;
б – сорбит.
В легированных сталях, благодаря присутствию специальных элементов, для образования мартенсита не требуется столь большой скорости охлаждения, как для углеродистых сталей, и мартенсит образуется при охлаждении в масле, а для быстрорежущих сталей – и при охлаждении на воздухе.
Троостит и сорбит можно получить не только в результате ускоренного охлаждения, нои путем нагрева закаленной стали, имеющей структуру мартенсита, до температуры ниже Aс1, т. е. путем отпуска стали. В этом случае троостит получается при нагреве стали до 400°, а сорбит-при нагреве до 650°. При нагреве до промежуточных температур получаются смешанные структуры: при нагреве от 250-400° – мартенсит и троостит и при нагреве от 400-650° – троостит и сорбит. В производственных условиях троостит и сорбит получают путем отпуска закаленной стали.
Превращения, происходящие в стали при охлаждении в среде, имеющей температуру выше 200° (изотермическое превращение)
Если деталь, нагретую выше критической точки, поместить в среду, имеющую температуру от 700 до примерно 200°, и выдержать в ней до выравнивания температуры по всему сечению, то аустенит превратится в ту структуру, которая соответствует превращению при данной температуре.
О поведении стали при изотермической обработке, выборе температуры и времени выдержки судят по кривым изотермического превращения, построенным для разных марок стали.
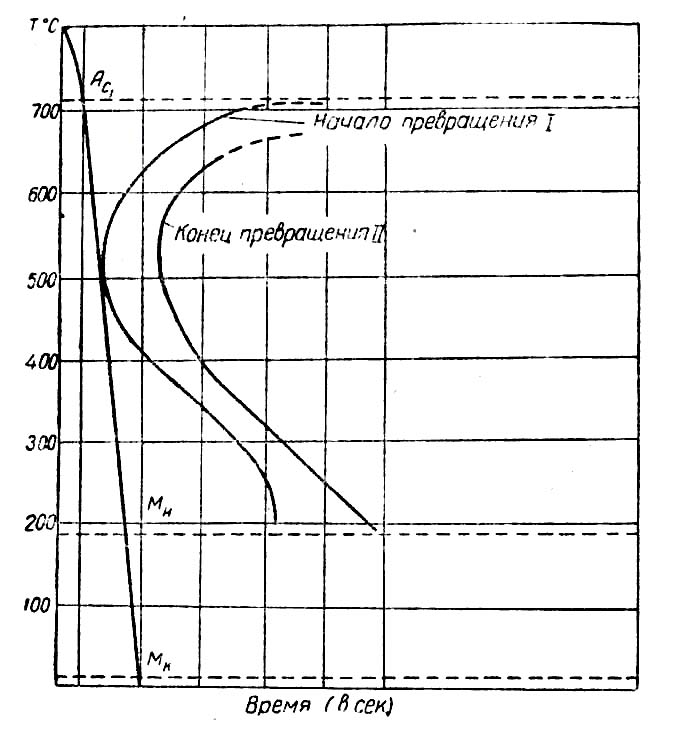
Рис. 7. Диаграмма изотермического превращения аустенита углеродистой стали.
На рис. 7 дан вид диаграммы изотермического превращения в стали. На горизонтальной оси отложено время начала и конца превращения, а на вертикальной- температура, при которой оно происходит. Линия А с соответствует переходу аустенита в перлит, а линия Мн – образованию мартенсита из аустенита. На кривой I начинаются, а на кривой II заканчиваются структурные превращения.
Если углеродистую инструментальную сталь, нагретую до 800°, поместить в масло, расплавленную соль или щелочь при температуре 250°, в ней образуется игольчатый троостит с высокой твердостью Rc=45-55. Если эту же сталь охладить в среде, имеющей температуру свыше 600°, в ней образуется перлит и такая сталь легко обрабатывается на станках. При охлаждении стали в среде с промежуточными температурами образуются структуры троостита и сорбита с соответствующей твердостью.
Изотермический отжиг нашел большое применение при термической обработке инструментальных сталей как процесс, резко уменьшающий время по сравнению с другими видами отжига.
Изотермическая закалка в инструментальном деле применяется редко из-за недостаточной для инструмента твердости, достигаемой при этом процессе.
Источник:
Остапенко Н.Н.,Крапивницкий Н.Н. Технология металлов. М. Высшая школа,1970г.
Каменичный И.С. Практика термической обработки инструмента. Киев, 1959 г.
Источник